คู่กรด-คู่เบส+ความแรงของกรด-เบส


![]() คู่กรด – เบส
คู่กรด – เบส
จากปฏิกิริยาของกรด - เบสที่กล่าวมาข้างต้น ตามทฤษฎีของเบรินสเตต - ลาวรี จะเห็นได้ว่าในปฏิกิริยาหนึ่งๆ อาจจัดคู่กรด – เบสได้ทั้งหมด 2 คู่ด้วยกัน เช่น
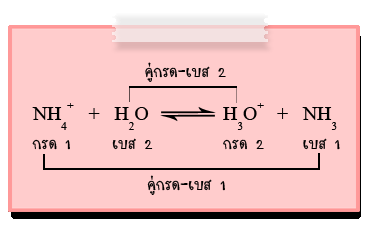
ปฏิกิริยาดังตัวอย่างนี้ ปฏิกิริยาไปข้างหน้า NH4+ ทำหน้าที่เป็นกรด เพราะให้ H+ กับ H2O แล้วได้เป็น NH3 ขณะที่ H2O รับ H+ ดังนั้นจึงทำหน้าที่เป็นเบส ส่วนปฏิกิริยาย้อนกลับ H3O+ เป็นกรด เพราะให้ H+ กับ NH3 ซึ่งเป็นเบส แล้วได้เป็น H2O และ NH4+ ตามลำดับ
เรียก NH4+ ว่าคู่กรดของ NH3 (เบส)
H2O ว่าคู่เบสของ H3O+ (กรด)
NH3 ว่าคู่เบสของ NH4+ (กรด)
H3O+ ว่าคู่กรดของ H2O (เบส)
จากตัวอย่างที่กล่าวมาข้างต้น จะเห็นได้ว่า คู่กรด - เบสนั้นมีจำนวนโปรตอน (H+) ต่างกัน 1 ตัว หรืออาจกล่าวได้ว่า จำนวนโปรตอนของคู่กรด จะมากกว่าจำนวนโปรตอนของคู่เบสอยู่ 1 ตัวเสมอ

![]() ความแรงของกรด - เบส
ความแรงของกรด - เบส
การเปรียบเทียบความแรงของกรด - เบส อาจพิจารณาได้ ดังนี้
1. สังเกตจากการแตกตัวของกรด
กรดที่แตกตัวมาก จะมีความเป็นกรดมาก กรดและเบสตัวใดที่แตกตัวได้ 100% จะเรียกว่า กรดแก่ และเบสแก่ ตามลำดับ มีความสามารถในการนำไฟฟ้าได้ดี แต่ถ้ากรดหรือเบสตัวใดแตกตัวได้เพียงบางส่วนจะเรียกว่า กรดอ่อน หรือเบสอ่อน ตามลำดับ ซึ่งความสามารถในการนำไฟฟ้าก็จะไม่ดีตามไปด้วย
สำหรับการพิจารณาค่าการแตกตัวของกรดและเบสนั้น นอกจากจะคิดในรูปแบบของเปอร์เซ็นต์การแตกตัวแล้ว ยังสามารถดูได้จากค่าคงที่สมดุลของการแตกตัวของกรดหรือเบส (Ka หรือ Kb) นั้นๆได้ด้วย เช่น
สารละลายของกรดทั้ง 4 ชนิด มีค่าคงที่ของการแตกตัวของกรด ดังนี้
HClO2 Ka = 1.1 x 10-2
HF Ka = 6.8 x 10-4
CH3COOH Ka = 1.8 x 10-5
H2CO3 Ka = 4.4 x 10-7
ความแรงของกรดเรียงลำดับจากมากไปหาน้อยตามค่า Ka ได้ดังนี้
HClO2 > HF > CH3COOH > H2CO3
ส่วนความแรงของเบสนั้น ให้พิจารณาจากค่า Kb คือ ถ้าค่า Kb มาก สารละลายนั้นจะมีความเป็นเบสมากกว่าสารละลายที่มี Kb น้อย เช่น
NH3 Kb = 1.76 x 10-5
N2H4 Kb = 9.5 x 10-7
C6H5NH2 Kb = 4.3 x 10-10
ความแรงของเบสเรียงลำดับจากมากไปหาน้อยตามค่า Kb ได้ดังนี้
NH3 > N2H4 > C6H5NH2
2. สังเกตจากความสามารถในการให้และรับโปรตอน
กรดแก่, เบสแก่ คือ กรดหรือเบสที่ให้โปรตอนได้มาก
กรดอ่อน, เบสอ่อน คือ กรดหรือเบสที่ให้โปรตอนได้น้อย
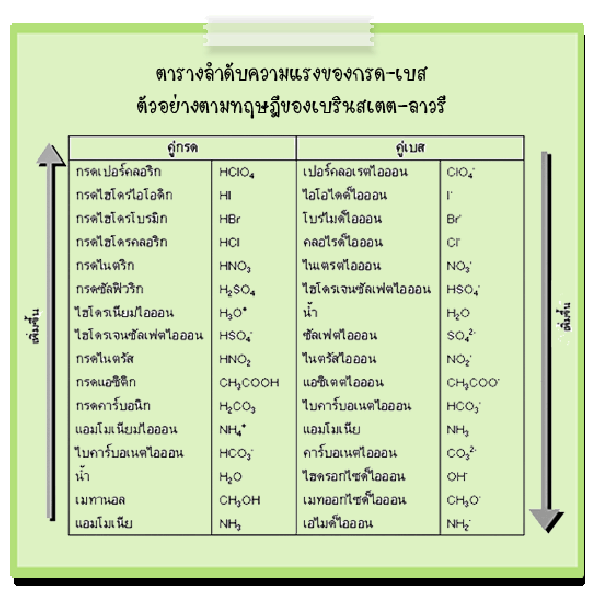
3. สังเกตจากการเรียงลำดับในตารางธาตุ
การพิจารณาความแรงของกรด – เบส สังเกตได้จากการเรียงลำดับของธาตุที่อยู่ในกรดตามตารางธาตุ ซึ่งแบ่งได้ ดังนี้
3.1 กรดออกซี หมายถึง กรดที่ประกอบด้วย H, O และธาตุอื่นอีก เช่น HNO3, H3PO4, H3AsO4, HClO4 เป็นต้น ถ้าจำนวนอะตอมออกซิเจนเท่ากัน ความแรงของกรดจะมีการเรียงลำดับดังนี้
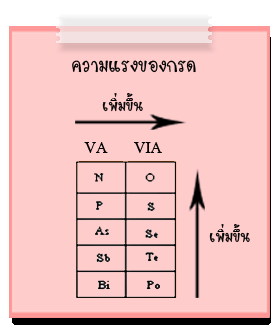
ดังนั้น H2SO4 > H2SeO4 , H3PO4 > H3AsO4
3.2 กรดไฮโดร หมายถึง กรดที่ไม่มีออกซิเจน เช่น HCl, HBr, HF, และ HI เป็นต้น โดยความแรงของกรดจะเรียงตามลำดับดังนี้
HI > HBr > HCl > HF
H2S > H2O