ทฤษฎีกรด-เบส(1)


![]() ทฤษฎีกรด - เบส อาร์เรเนียส (Arrhenius)
ทฤษฎีกรด - เบส อาร์เรเนียส (Arrhenius)
ในปี ค.ศ. 1887 (พ.ศ. 2430) นักวิทยาศาสตร์ชาวสวีเดน ชื่อ อาร์เรเนียส ได้เป็นผู้ตั้งทฤษฎีกรด – เบสขึ้น โดยศึกษาจากสารที่ละลายน้ำ (Aqueous solution ; aq) และการนำไฟฟ้าของสารละลายนั้น ซึ่งอาร์เรเนียสได้พบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน เมื่อละลายอยู่ในน้ำจึงให้นิยามกรดไว้ว่า
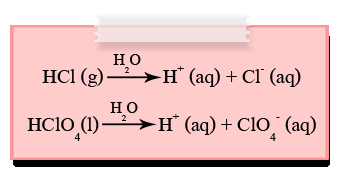
กรด คือ สารที่ละลายน้ำแล้วสามารถแตกตัวให้ไฮโดรเจนไอออน (H+)ได้ เช่น
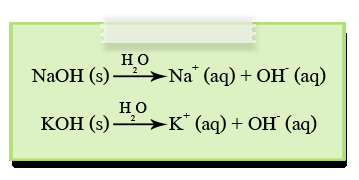
เบส คือ สารที่ละลายน้ำแล้วสามารถแตกตัวให้ไฮดรอกไซด์ไอออน (OH-)ได้ เช่น
- ข้อจำกัดของทฤษฎีกรด - เบส อาร์เรเนียส
- ทฤษฎีกรด - เบส อาร์เรเนียส จะเน้นเฉพาะการแตกตัวในน้ำให้ได้เป็น H+ และ OH- ไม่รวมถึงตัวทำละลายอื่นๆ ทำให้สามารถอธิบายความเป็นกรด - เบสได้อย่างจำกัด
- สารที่เป็นกรดจะต้องมี H+ อยู่ในโมเลกุล และสารที่เป็นเบสจะต้องมี OH- อยู่ในโมเลกุล
![]() ทฤษฎีกรด - เบส เบรินสเตต-ลาวรี (Bronsted - Lowry)
ทฤษฎีกรด - เบส เบรินสเตต-ลาวรี (Bronsted - Lowry)
โจฮันส์ นิโคลัส เบรินสเตต และโทมัส มาร์ติน ลาวรี นักเคมีชาวเดนมาร์ก และอังกฤษ ได้ศึกษาการให้และรับโปรตอนของสาร เพื่อใช้อธิบายและจำแนกกรด - เบสได้กว้างยิ่งขึ้น จึงได้มีการตั้งทฤษฎีกรด - เบสนี้ขึ้นในปี ค.ศ.1923 (พ.ศ. 2466)
กรด คือ สารที่ให้โปรตอนกับสารอื่น (Proton donor)
เบส คือ สารที่รับโปรตอนจากสารอื่น (Proton acceptor)
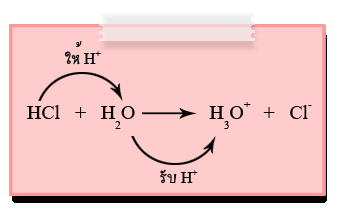
HCl เป็นสารที่ให้โปรตอน (H+) ; HCl จึงเป็นกรด
H2O เป็นสารที่รับโปรตอน (H+) ; H2O จึงเป็นเบส
- ข้อจำกัดของทฤษฎีกรด – เบส เบรินสเตต – ลาวรี
ทฤษฎีกรด- เบสของเบรินสเตต - ลาวรี เป็นทฤษฎีที่ใช้ในการอธิบายสมบัติของกรด - เบสได้กว้างกว่าทฤษฎีของอาร์เรเนียส แต่อย่างไรก็ตามทฤษฎีนี้ก็ยังมีข้อจำกัด คือ สารที่ทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น และสารนั้นจะต้องแตกตัวได้ เพราะถ้าสารไม่สามารถแตกตัวได้แล้วจะระบุไม่ได้ว่าสารนั้นเป็นกรดหรือเบส