ไฟฟ้าเคมี
เซลล์ไฟฟ้าเคมี (Electrochemical Cells)
ปฏิกิริยา Oxidation-Reduction ส่วนมากจะเกิดขึ้นเองตามธรรมชาติ และจะไม่ให้พลังงาน ตัวอย่างของปฏิกิริยาเหล่านี้คือ การนำโลหะสังกะสีใส่ลงไปในสารละลายที่มีประจุไฟฟ้าทองแดงอยู่โดยจะแสดงดังสมการ
Cu+2 (aq) + Zn (s) -------> Cu(s) + Zn+2 (aq)
โลหะสังกะสีจะค่อยๆละลายช้าๆ เนื่องจากประจุไฟฟ้าของสังกะสีเกิดการ Oxidation เมื่อใส่ลงไปในสารละลาย และในเวลาเดียวกันประจุไฟฟ้าของทองแดงก็ได้รับอิเล็กตรอนและถูกทำให้เป็นอะตอมทองแดง โลหะสังกะสีจะถูกกัดกร่อนและตกตะกอนอยู่ข้างใต้ภาชนะที่ใส่ไว้ พลังงานที่เกิดขึ้นนี้จะเกิดขึ้นเร็วมาก และจะกระจัดกระจายอยู่ จะอยู่ในรูปของความร้อนและสามารถที่จะนำมาใช้ประโยชน์เป็นพลังงานไฟฟ้าจ่ายให้กับอุปกรณ์ต่างๆที่ต้องการพลังงานได้ เรียกพลังงานเหล่านั้นว่าไฟฟ้าเคมี
เซลล์ไฟฟ้าเคมีจะประกอบด้วย 2 เซลล์ด้วยกัน ซึ่งเซลล์ทั้งสองนั้นจะแยกออกจากกัน โดยจะแบ่งเป็น 2 ภาชนะ ซึ่งในแต่ละภาชนะจะประกอบด้วยขั้วประจุไฟฟ้าที่จุ่มลงไปในสารละลาย ทั้งสองเซลล์จะมีเซลล์หนึ่งที่ทำปฏิกิริยา Oxidation และอีกเซลล์หนึ่งก็ทำปฏิกิริยา Reduction จะแสดงดังภาพข้างล่าง
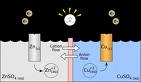
เซลล์ไฟฟ้าตัวแรกจะเรียกว่าขั้ว Anode จะมีการเกิดปฏิกิริยา Oxidation ของโลหะสังกะสีซึ่งจะแสดงดังสมการข้างล่าง
Zn (s) ----------> Zn+2 (aq) + 2e-
ระหว่างที่เกิดปฏิกิริยา Oxidation ขึ้นที่โลหะสังกะสี ขั้วไฟฟ้าของสังกะสีจะค่อยๆละลายช้าๆ และทำให้เกิดประจุไฟฟ้าของสังกะสีในสารละลาย ที่มีประจุ Zn+2 (aq) และ SO4-2(aq) ส่วนเซลล์ไฟฟ้าตัวที่สองเรียกว่าขั้ว Cathode จะเกิดปฏิกิริยา Reduction ของโลหะทองแดงขึ้น ซึ่งจะแสดงดังสมการข้างล่าง
Cu+2 (aq) + 2e- -------> Cu (s)
เมื่อประจุไฟฟ้าของทองแดง(Cu+2) เกิดปฏิกิริยา Reduction อะตอมของทองแดงก็จะมากขึ้นและจะเกาะอยู่ที่ผิวของขั้วตัวนำไฟฟ้าทองแดง การเกิด Reduction ของเซลล์แต่ละเซลล์จะเกิดขึ้นได้น้อยมากถ้าหากเซลล์ทั้งสองมีการเชื่อมต่อถึงกันอยู่
สำหรับการเกิด ปฏิกิริยา Oxidation นั้นจะต้องเกิดพร้อมๆกับการเกิดปฏิกิริยา Reduction ซี่งจะมีการเชื่อมโยงถึงกัน แต่ถ้าเกิดเราแยกเซลล์ไว้แต่ละเซลล์ ความ ไม่สมดุลย์ทางไฟฟ้าก็จะเกิดขึ้น ที่ขั้วของสังกะสีก็จะเกิดศักย์ไฟฟ้าเป็นบวก เรียกว่าขั้ว Anode และที่ขั้วของทองแดงก็จะเกิดศักย์ไฟฟ้าเป็นลบ เรียกว่า ขั้ว Cathode ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้สะพานเกลือ (salt bridge) เชื่อมต่อระหว่าง 2 เซลล์ดังแสดงดังภาพข้างล่าง สะพานเกลือนั้นคือ สิ่งที่ป้องกันที่เกิดขึ้นจากการผสมของสารละลายที่เกิดจากน้ำที่อยู่ในภาชนะนั้นๆ และจะทำการย้ายประจุไฟฟ้าทั้งสองไปในทิศทางการไหลของกระแสไฟฟ้าคือไหลจากขั้วบวกมาขั้วลบก็จะหมือนกับการเกิดปฏิกิริยา Oxidation-Reduction จากขั้ว Anode ผ่านสะพานเกลือ จนไปถึงขั้ว Cathode นอกจากนั้นเซลล์ทั้งสองยังสามารถที่จะเชื่อมต่อกับภายนอกได้ ซึ่งในการจัดอิเล็กตรอนสามารถที่จะทำได้โดยการเตรียมปฏิกิริยา Oxidation แล้วทำการให้พลังงานเพื่อให้มันไหลไปตามทิศทางผ่านไปยังวงจรภายนอก และไหลไปหายังปฏิกิริยา Reduction จากที่กล่าวมาแล้ว การเกิดปฏิกิริยาขึ้นเองครั้งละครึ่งเซลล์จะเชื่อมต่อถึงกันและทำให้เกืดพลังงานแตกต่างกันไป ความแตกต่างของพลังงานนี้เราเรียกว่า Electromotive Force(emf) และมีหน่วยวัดที่เรียกว่า Volt เซลล์ของสังกะสีและทองแดงจะมีค่า (emf) อยู่ประมาณ 1.1 Volt เมื่อคิดตามมารฐาน
อุปกรณ์ที่ได้มีการนำเอาไฟฟ้ามาใช้จะสามารถ " spliced" เข้าไปในวงจรซึ่งอาจจะเกิดพลังงานขึ้นได้โดยการผลิตเซลล์สำหรับที่จะใช้ประโยชน์ในงานนั้นๆ ถึงแม้ว่าพลังงานจะหามาได้จากเซลล์ไฟฟ้าเดี่ยวซึ่งมีพลังงานไม่ค่อยมาก เซลล์ไฟฟ้าเคมีสามารถที่จะเชื่อมต่อกันเข้าเป็นชุดๆ เพื่อเป็นการเพิ่มพลังงานที่ออกมาทาง Output ให้มากขึ้น โดยทั่วไปเราจะใช้ประโยชน์จากเซลล์ที่นำมาต่อกันเป็น แบตเตอรี่ ตัวอย่างเช่น แบตเตอรี่ตะกั่วที่ใช้กันอยู่ในรถยนต์ และในตะกั่วแบตเตอรี่แต่ละเซลล์ก็จะมีโลหะตะกั่วเป็นขั้ว Anode และมี ตะกั่ว Oxide เป็นขั้ว Cathode ซึ่งทั้งคู่จะจุ่มลงไปในกรดสารละลายกรดซัลฟูริค ( Sulfuric) ไฟฟ้าเคมีประเภทนี้จะมีการผลิตแรงดันไฟฟ้าประมาณ 2 Volt เมื่อนำมาเชื่อมต่อกัน 6 เซลล์ก็จะทำให้เกิดแรงดัน =12 Volt ซึ่งแบตเตอรี่ชนิดนี้ในปัจจุบันจะใช้กันมากในรถยนต์ ยิ่งนานวันอุปกรณ์ชนิดนี้ก็ยิ่งเพิ่มขึ้น เพราะว่ามันเป็นแหล่งกำเนิดของพลังงานที่สามารถที่จะพกพาไปไหนต่อไหนได้สะดวก
- « แรก
- ‹ หน้าก่อน
- 1
- 2







